| 组织蛋白酶C |
|---|
 |
| 已知的結構 |
|---|
| PDB | 直系同源搜索: PDBe RCSB |
|---|
| PDBID列表 |
|---|
4OEM、1K3B、2DJF、2DJG、3PDF、4CDC、4CDD、4CDE、4CDF、4OEL |
|
|
| 識別號 |
|---|
| 别名 | CTSC;, CPPI, DPP-I, DPP1, DPPI, HMS, JP, JPD, PALS, PDON1, PLS, cathepsin C |
|---|
| 外部ID | OMIM:602365 MGI:109553 HomoloGene:1373 GeneCards:CTSC |
|---|
|
| 相關疾病 |
|---|
| 掌跖角化-牙周破坏综合征、Haim–Munk syndrome、牙周炎、侵袭性牙周炎、慢性牙周病[1] |
|
| 基因位置(小鼠) |
|---|
 | | 染色体 | 小鼠7号染色体[3] |
|---|
| | 基因座 | 7|7 D3 | 起始 | 87,927,293 bp[3] |
|---|
| 终止 | 87,960,096 bp[3] |
|---|
|
| RNA表达模式 |
|---|
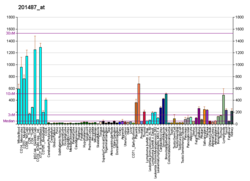 |
| 查阅更多表达数据 |
| 基因本體 |
|---|
| 分子功能 | • peptidase activator activity involved in apoptotic process
• phosphatase binding
• 半胱氨酸型肽酶活性
• chaperone binding
• 蛋白質自締合
• 肽酶活性
• 血浆蛋白结合
• 相同蛋白质结合
• chloride ion binding
• cysteine-type endopeptidase activity
• serine-type endopeptidase activity
• 水解酶活性
|
|---|
| 細胞組分 | • 高尔基体
• endoplasmic reticulum lumen
• 膜
• 内质网
• COPII-coated ER to Golgi transport vesicle
• 溶酶体
• 外排體
• endoplasmic reticulum-Golgi intermediate compartment membrane
• Golgi membrane
• 細胞外區域
• 細胞外空間
• 核质
• 中心体
• azurophil granule lumen
• 細胞內膜結合細胞器
• collagen-containing extracellular matrix
• 細胞質
|
|---|
| 生物學過程 | • 老化
• positive regulation of proteolysis involved in cellular protein catabolic process
• positive regulation of apoptotic signaling pathway
• response to organic substance
• 蛋白酶解
• endoplasmic reticulum to Golgi vesicle-mediated transport
• COPII vesicle coating
• 免疫反应
• proteolysis involved in cellular protein catabolic process
• T cell mediated cytotoxicity
• 细胞凋亡
• neutrophil degranulation
• negative regulation of myelination
• positive regulation of microglial cell activation
|
|---|
| Sources:Amigo / QuickGO |
|
| 直系同源 |
|---|
| 物種 | 人類 | 小鼠 |
|---|
| Entrez | | |
|---|
| Ensembl | | |
|---|
| UniProt | | |
|---|
| mRNA序列 | |
|---|
NM_148170
NM_001114173
NM_001814 |
| |
|---|
| 蛋白序列 | |
|---|
NP_001107645
NP_001805
NP_680475 |
| |
|---|
| 基因位置(UCSC) | Chr 11: 88.27 – 88.36 Mb | Chr 7: 87.93 – 87.96 Mb |
|---|
| PubMed查找 | [4] | [5] |
|---|
| 維基數據 |
|
| 组织蛋白酶C排斥域 |
|---|
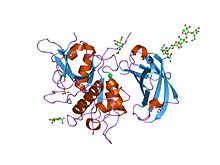 重新测定人二肽基肽酶i(组织蛋白酶 c)的天然结构 |
| 鑑定 |
|---|
| 標誌 | CathepsinC_exc |
|---|
| Pfam | PF08773(旧版) |
|---|
| InterPro(英语:InterPro) | IPR014882 |
|---|
| SCOP(英语:Structural Classification of Proteins) | 1k3b / SUPFAM |
|---|
| 現有可用的蛋白結構: |
|---|
| Pfam | 結構(旧版) / ECOD |
|---|
| PDB | RCSB PDB; PDBe; PDBj |
|---|
| PDBsum(英语:PDBsum) | 結構概要 |
|---|
|
组织蛋白酶C(EC 3.4.14.1)也称为二肽基肽酶I(DPP-I,酶学委员会接受的名字),是一种溶酶体外切半胱氨酸蛋白酶,属于肽酶C1蛋白质家族,是半胱氨酸组织蛋白酶的一个亚组。在人类中,它由CTSC基因编码。[6][7]
功能
组织蛋白酶C似乎是激活免疫/炎症细胞中许多丝氨酸蛋白酶的中心协调因子。
组织蛋白酶C催化从蛋白质和肽底物的N端切除二肽,除非
- N端的胺基被阻断
- 切割位点位于脯氨酸残基的任一侧
- N端残基是赖氨酸或精氨酸
- 肽或蛋白质的结构阻止从N端进一步消化。
结构
编码大鼠、人、鼠类、牛、狗和两种血吸虫组织蛋白酶C的cDNA已被克隆和测序,表明该酶是高度保守的。[8]人和大鼠组织蛋白酶C的cDNA编码前体(前组织蛋白酶C),包括24个残基的信号肽、205个(大鼠组织蛋白酶C)或206个(人组织蛋白酶C)残基的前区和233个残基的催化结构域,其中含有催化残基,与木瓜蛋白酶和许多其他组织蛋白酶的成熟氨基酸序列有30至40%的相同性,包括组织蛋白酶B、H、K、L和S。[9]
通过多肽链的至少四次切割,将已翻译的前组织蛋白酶原C加工成成熟形式。信号肽在酶原(组织蛋白酶原C)的易位或分泌过程中被去除,并且保留在成熟酶中的大的N端前区片段(也称为排斥域)[10]与催化分离通过切除前区的一个较小的C端部分,称为激活肽。通过催化结构域的切割产生约164个残基的重链和约69个残基的轻链。
与木瓜蛋白酶家族的其他成员不同,成熟的组织蛋白酶C由四个亚基组成,每个亚基由N端前区片段、重链和轻链组成。前区片段和重链都被糖基化。
临床意义
编码蛋白质的缺陷已被证明是导致掌跖角化-牙周破坏综合征(英语:Papillon–Lefèvre_syndrome)的原因,[11][12]这是一种以掌跖角化和牙周炎为特征的常染色体隐性遗传病。
组织蛋白酶C是激活炎症细胞中颗粒丝氨酸肽酶的关键酶,例如中性粒细胞中的弹性蛋白酶和组织蛋白酶G,以及肥大细胞中的糜酶(英语:Chymase)和类胰蛋白酶(英语:Tryptase)。在许多炎性疾病中,例如类风湿性关节炎、慢性阻塞性肺病、炎症性肠病、哮喘、败血症和囊性纤维化,发病机制的很大一部分是由这些炎性蛋白酶中的一些活性增加引起的。一旦被组织蛋白酶C激活,蛋白酶就能够降解各种细胞外基质成分,从而导致组织损伤和慢性炎症。
参考文献
- ^ 與组织蛋白酶C相關的疾病;在維基數據上查看/編輯參考.
- ^ 2.0 2.1 2.2 GRCh38: Ensembl release 89: ENSG00000109861 - Ensembl, May 2017
- ^ 3.0 3.1 3.2 GRCm38: Ensembl release 89: ENSMUSG00000030560 - Ensembl, May 2017
- ^ Human PubMed Reference:. National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Mouse PubMed Reference:. National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Entrez Gene: CTSC cathepsin C.
- ^ Paris A, Strukelj B, Pungercar J, Renko M, Dolenc I, Turk V. Molecular cloning and sequence analysis of human preprocathepsin C. FEBS Letters. Aug 1995, 369 (2–3): 326–30. PMID 7649281. S2CID 45737414. doi:10.1016/0014-5793(95)00777-7
 .
. - ^ Hola-Jamriska, Lubomira; Tort, Jose F.; Dalton, John P.; Day, Sharon R.; Fan, Jinjiang; Aaskov, John; Brindley, Paul J. Cathepsin C from Schistosoma japonicum . cDNA encoding the preproenzyme and its phylogenetic relationships. European Journal of Biochemistry. 1998-08, 255 (3). ISSN 0014-2956. doi:10.1046/j.1432-1327.1998.2550527.x (英语).
- ^ Kominami E, Ishido K, Muno D, Sato N. The primary structure and tissue distribution of cathepsin C. Biological Chemistry Hoppe-Seyler. Jul 1992, 373 (7): 367–73. PMID 1515062. doi:10.1515/bchm3.1992.373.2.367.
- ^ Turk, Dušan; Janjić, Vojko; Štern, Igor; Podobnik, Marjetka; Lamba, Doriano; Weis Dahl, Søren; Lauritzen, Connie; Pedersen, John; Turk, Vito; Turk, Boris. Structure of human dipeptidyl peptidase I (cathepsin C): exclusion domain added to an endopeptidase framework creates the machine for activation of granular serine proteases. The EMBO Journal. 2001-12-03, 20 (23) [2022-09-17]. ISSN 0261-4189. PMID 11726493. doi:10.1093/emboj/20.23.6570. (原始内容存档于2022-09-22).
- ^ Wani AA, Devkar N, Patole MS, Shouche YS. Description of two new cathepsin C gene mutations in patients with Papillon-Lefèvre syndrome. Journal of Periodontology. Feb 2006, 77 (2): 233–7. PMID 16460249. doi:10.1902/jop.2006.050124.
- ^ Meade JL, de Wynter EA, Brett P, Sharif SM, Woods CG, Markham AF, Cook GP. A family with Papillon-Lefevre syndrome reveals a requirement for cathepsin C in granzyme B activation and NK cell cytolytic activity. Blood. May 2006, 107 (9): 3665–8. PMID 16410452. doi:10.1182/blood-2005-03-1140
 .
.



 .
.  .
. 















