HSPA8
| HSPA8 | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||
| |||||||||||||||||
| Ідентифікатори | |||||||||||||||||
| Символи | HSPA8, HEL-33, HEL-S-72p, HSC54, HSC70, HSC71, HSP71, HSP73, HSPA10, LAP-1, LAP1, NIP71, heat shock protein family A (Hsp70) member 8 | ||||||||||||||||
| Зовнішні ІД | OMIM: 600816 MGI: 105384 HomoloGene: 68524 GeneCards: HSPA8 | ||||||||||||||||
| |||||||||||||||||
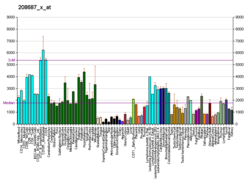
| Шаблон експресії | |||||||||||||||||
   | |||||||||||||||||
| Більше даних | |||||||||||||||||
| Ортологи | |||||||||||||||||
| Види | Людина | Миша | |||||||||||||||
| Entrez |
|
| |||||||||||||||
| Ensembl |
|
| |||||||||||||||
| UniProt |
|
| |||||||||||||||
| RefSeq (мРНК) |
|
| |||||||||||||||
| RefSeq (білок) |
|
| |||||||||||||||
| Локус (UCSC) | Хр. 11: 123.06 – 123.06 Mb | Хр. 9: 40.71 – 40.72 Mb | |||||||||||||||
| PubMed search | [1] | [2] | |||||||||||||||
| Вікідані | |||||||||||||||||
| |||||||||||||||||
HSPA8 – ген, що кодує білок англ. Heat shock protein family A (Hsp70) member 8 і розташований у людей на короткому плечі 11-ї хромосоми.[3] Довжина поліпептидного ланцюга кодованого геном білка становить 646 амінокислот, а молекулярна маса — 70 898[4].
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MSKGPAVGID | LGTTYSCVGV | FQHGKVEIIA | NDQGNRTTPS | YVAFTDTERL | ||||
| IGDAAKNQVA | MNPTNTVFDA | KRLIGRRFDD | AVVQSDMKHW | PFMVVNDAGR | ||||
| PKVQVEYKGE | TKSFYPEEVS | SMVLTKMKEI | AEAYLGKTVT | NAVVTVPAYF | ||||
| NDSQRQATKD | AGTIAGLNVL | RIINEPTAAA | IAYGLDKKVG | AERNVLIFDL | ||||
| GGGTFDVSIL | TIEDGIFEVK | STAGDTHLGG | EDFDNRMVNH | FIAEFKRKHK | ||||
| KDISENKRAV | RRLRTACERA | KRTLSSSTQA | SIEIDSLYEG | IDFYTSITRA | ||||
| RFEELNADLF | RGTLDPVEKA | LRDAKLDKSQ | IHDIVLVGGS | TRIPKIQKLL | ||||
| QDFFNGKELN | KSINPDEAVA | YGAAVQAAIL | SGDKSENVQD | LLLLDVTPLS | ||||
| LGIETAGGVM | TVLIKRNTTI | PTKQTQTFTT | YSDNQPGVLI | QVYEGERAMT | ||||
| KDNNLLGKFE | LTGIPPAPRG | VPQIEVTFDI | DANGILNVSA | VDKSTGKENK | ||||
| ITITNDKGRL | SKEDIERMVQ | EAEKYKAEDE | KQRDKVSSKN | SLESYAFNMK | ||||
| ATVEDEKLQG | KINDEDKQKI | LDKCNEIINW | LDKNQTAEKE | EFEHQQKELE | ||||
| KVCNPIITKL | YQSAGGMPGG | MPGGFPGGGA | PPSGGASSGP | TIEEVD |
Кодований геном білок за функціями належить до шаперонів, репресорів. Задіяний у таких біологічних процесах як взаємодія хазяїн-вірус, процесінг мРНК, сплайсінг мРНК, відповідь на стрес, транскрипція, регуляція транскрипції. Білок має сайт для зв'язування з АТФ, нуклеотидами. Локалізований у клітинній мембрані, цитоплазмі, ядрі, мембрані.
Література
- Dworniczak B.P., Mirault M.-E. (1987). Structure and expression of a human gene coding for a 71 kd heat shock 'cognate' protein. Nucleic Acids Res. 15: 5181—5197. PMID 3037489 DOI:10.1093/nar/15.13.5181
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC). Genome Res. 14: 2121—2127. 2004. PMID 15489334 DOI:10.1101/gr.2596504
- Egerton M., Moritz R.L., Druker B., Kelso A., Simpson R.J. (1996). Identification of the 70kD heat shock cognate protein (Hsc70) and alpha-actinin-1 as novel phosphotyrosine-containing proteins in T lymphocytes. Biochem. Biophys. Res. Commun. 224: 666—674. PMID 8713105 DOI:10.1006/bbrc.1996.1082
- Cloutier P., Lavallee-Adam M., Faubert D., Blanchette M., Coulombe B. (2013). A newly uncovered group of distantly related lysine methyltransferases preferentially interact with molecular chaperones to regulate their activity. PLoS Genet. 9: E1003210—E1003210. PMID 23349634 DOI:10.1371/journal.pgen.1003210
- Sainis L., Angelidis C., Pagoulatos G.N., Lazaridis L. (2000). HSC70 interactions with SV40 viral proteins differ between permissive and nonpermissive mammalian cells. Cell Stress Chaperones. 5: 132—138. PMID 11147964 DOI:10.1379/1466-1268(2000)005<0132:HIWSVP>2.0.CO;2
- Triantafilou K., Triantafilou M., Dedrick R.L. (2001). A CD14-independent LPS receptor cluster. Nat. Immunol. 2: 338—345. PMID 11276205 DOI:10.1038/86342
Примітки
- ↑ Human PubMed Reference:.
- ↑ Mouse PubMed Reference:.
- ↑ HUGO Gene Nomenclature Commitee, HGNC:5241 (англ.) . Процитовано 6 лютого 2017.
{{cite web}}: Обслуговування CS1: Сторінки з параметром url-status, але без параметра archive-url (посилання) - ↑ UniProt, P11142 (англ.) . Архів оригіналу за 29 грудня 2016. Процитовано 6 лютого 2017.
Див. також
- Хромосома 11
 | Це незавершена стаття про білки. Ви можете допомогти проєкту, виправивши або дописавши її. |
| Ця стаття недостатньо чи зовсім не категоризована, або категорії, до яких вона належить, не існують. Будь ласка, допоможіть додати належні категорії, аби цю статтю можна було категоризувати із суміжними сторінками. (січень 2024) |









