Kolonnkromatografi

Kolonnkromatografi är en metod inom den analytiska kemin som har i uppgift att skilja olika molekyler i en blandning från varandra. Kromatografi kan separera ämnen baserat på differentiell adsorption av föreningar till adsorbenten. Föreningar rör sig genom kolonnen i olika hastigheter, vilket gör att de kan separeras i fraktioner. Tekniken är allmänt användbar, eftersom många olika adsorbenter (normalfas, omvänd fas eller annat) kan användas med ett brett utbud av lösningsmedel. Tekniken kan användas på skalor från mikrogram upp till kilogram. Den största fördelen med kolonnkromatografi är den relativt låga kostnaden och engångsbarheten för den stationära fasen som används i processen. Det senare förhindrar korskontaminering och nedbrytning i stationär fas på grund av återvinning. Kolonnkromatografi kan göras med hjälp av gravitation för att flytta lösningsmedlet, eller med hjälp av komprimerad gas för att trycka lösningsmedlet genom kolonnen.
En tunnskiktskromatograf kan visa hur en blandning av föreningar kommer att bete sig när den renas med kolonnkromatografi. Separationen optimeras först med tunnskiktskromatografi innan kolonnkromatografi utförs.

Kolumnförberedelse

Kolonnkromatografi består av en mobil fas och en stationär fas. Den mobila fasen låter man rinna genom den stationära fasen, som befinner sig i ett rör, en kolonn. Då kommer den mobila fasen dra med sig de molekyler som ska separeras olika mycket. Rörets bas innehåller ett filter, antingen en bomulls- eller glasullsplugg, eller glasfrit för att hålla den fasta fasen på plats. En lösningsmedelsbehållare kan vara fäst vid toppen av kolonnen.
Två metoder används vanligtvis för att förbereda en kolonn: den torra metoden och den våta metoden. För den torra metoden fylls kolonnen först med torrt pulver av stationär fas, följt av tillsats av mobil fas, som spolas genom kolonnen tills den är helt våt, och från denna punkt får den aldrig torka.[1] För den våta metoden bereds en slurry av eluenten med pulvret i stationär fas och hälls sedan försiktigt i kolonnen. Toppen av kiseldioxiden bör vara platt, och kan skyddas av ett lager av sand. Elueringsmedel leds långsamt genom kolonnen för att föra fram det organiska materialet.
De individuella komponenterna kvarhålls av den stationära fasen på olika sätt och separeras från varandra medan de löper med olika hastigheter genom kolonnen med eluenten. I slutet av kolonnen eluerar de en i taget. Under hela kromatografiprocessen samlas eluenten upp i en serie fraktioner. Dessa kan samlas upp automatiskt med hjälp av fraktionssamlare. Produktiviteten för kromatografi kan ökas genom att köra flera kolonner samtidigt. I detta fall används multiströmsamlare. Sammansättningen av eluentflödet kan övervakas och varje fraktion analyseras med avseende på lösta föreningar, till exempel genom analytisk kromatografi, UV-absorptionsspektra eller fluorescens. Färgade föreningar (eller fluorescerande föreningar med hjälp av en UV-lampa) kan ses genom glasväggen som rörliga band.
Stationär fas

Den stationära fasen eller adsorbenten i kolonnkromatografi är ett fast ämne. Den vanligaste stationära fasen för kolonnkromatografi är silikagel, den näst vanligaste är aluminiumoxid. Cellulosapulver har ofta använts tidigare. Ett brett utbud av stationära faser är tillgängliga för att utföra jonbyteskromatografi, omvänd faskromatografi (RP), affinitetskromatografi eller expanderad bäddadsorption (EBA). De stationära faserna är vanligtvis finmalda pulver eller geler och/eller är mikroporösa för en ökad yta, men i EBA används en fluidiserad bädd. Det finns ett viktigt förhållande mellan den stationära fasens vikt och torrvikten av analytblandningen som kan appliceras på kolonnen. För silikakolonnkromatografi ligger detta förhållande inom 20:1 till 100:1, beroende på hur nära varandra analytkomponenterna elueras.[2]
Mobil fas (eluent)
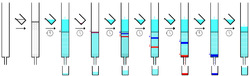
Den mobila fasen eller eluenten är ett lösningsmedel eller en blandning av lösningsmedel som används för att föra föreningarna genom kolonnen. Det väljs så att retentionsfaktorvärdet för föreningen av intresse är ungefär 0,2 - 0,3 för att minimera tiden och mängden elueringsmedel för att genomföra kromatografin. Eluenten väljs också så att de olika föreningarna kan separeras effektivt. Eluenten optimeras i småskaliga förtester, ofta med tunnskiktskromatografi (TLC) med samma stationära fas, med lösningsmedel med olika polaritet tills ett lämpligt lösningsmedelssystem hittas. Vanliga lösningsmedel i mobilfas, i ordning med ökande polaritet, är hexan, diklormetan, etylacetat, aceton och metanol.[3] Ett vanligt lösningsmedelssystem är en blandning av hexan och etylacetat, med proportioner justerade tills målföreningen har en retentionsfaktor på 0,2 - 0,3. Tvärtemot den vanliga missuppfattningen kan enbart metanol användas som elueringsmedel för högpolära föreningar och löser inte upp silikagel.
Det finns en optimal flödeshastighet för varje särskild separation. En snabbare flödeshastighet av eluenten minimerar den tid som krävs för att köra en kolonn och minimerar därigenom diffusion, vilket resulterar i en bättre separation. Den maximala flödeshastigheten är dock begränsad eftersom det krävs en ändlig tid för analyten att komma i jämvikt mellan den stationära fasen och den mobila fasen, (se Van Deemters ekvation). En enkel laboratoriekolonn drivs av gravitationsflöde. Flödeshastigheten för en sådan kolonn kan ökas genom att förlänga den färska eluentfyllda kolonnen ovanför toppen av den stationära fasen eller minskas med krankontrollerna. Snabbare flödeshastigheter kan uppnås genom att använda en pump eller genom att använda komprimerad gas (till exempel luft, kväve eller argon) för att trycka lösningsmedlet genom kolonnen (flashkolonnkromatografi).[4][5]

Partikelstorleken för den stationära fasen är i allmänhet finare vid flashkolonnkromatografi än vid gravitationskolonnkromatografi. Till exempel är en av de mest använda kiselgelkvaliteterna i den förra tekniken mesh 230 – 400 (40 – 63 μm), medan den senare tekniken vanligtvis kräver mesh 70 – 230 (63 – 200 μm) kiselgel.[6] Ett kalkylblad som hjälper till med framgångsrik utveckling av flashkolonner har utvecklats. Kalkylarket uppskattar retentionsvolymen och bandvolymen för analyter, fraktionstalen som förväntas innehålla varje analyt och upplösningen mellan intilliggande toppar. Denna information gör det möjligt för användare att välja optimala parametrar för separationer i preparativ skala innan själva flashkolumnen görs.[7]
Automatiserade system

Kolonnkromatografi är ett extremt tidskrävande steg i alla labb och kan snabbt bli flaskhalsen för alla processlabb. Många tillverkare som Biotage, Buchi, Interchim och Teledyne Isco har utvecklat automatiserade flashkromatografisystem (vanligtvis kallade LPLC, lågtrycksvätskekromatografi, runt 350–525 kPa) som minimerar mänsklig inblandning i reningsprocessen. Automatiserade system inkluderar komponenter som normalt finns på dyrare högpresterande vätskekromatografisystem (HPLC) som gradientpump, provinsprutningsportar, UV-detektor och fraktionsuppsamlare för att samla upp eluenten. Vanligtvis kan dessa automatiserade system separera prover från några milligram upp till en industriell mångkilogramskala och erbjuder en mycket billigare och snabbare lösning för att göra flera injektioner på prep-HPLC-system.
Upplösningen (eller förmågan att separera en blandning) på ett LPLC-system kommer alltid att vara lägre jämfört med HPLC, eftersom packningsmaterialet i en HPLC-kolonn kan vara mycket mindre, vanligtvis bara 5 mikrometer, vilket ökar den stationära fasens ytarea, vilket ökar ytinteraktionerna och ger bättre separation. Användningen av detta lilla förpackningsmedium orsakar emellertid det höga mottrycket och det är därför det kallas högtrycksvätskekromatografi. LPLC-kolonnerna är vanligtvis packade med kiseldioxid på cirka 50 mikrometer, vilket minskar mottrycket och upplösningen, men tar också bort behovet av dyra högtryckspumpar. Tillverkare börjar nu gå över till snabbkromatografisystem med högre tryck och har kallat dessa system för mediumtrycksvätskekromatografi (MPLC) som arbetar över 1 MPa.
Kolonnadsorptionsjämvikt
För en adsorptionskolonn är kolonnhartset (den stationära fasen) sammansatt av mikropärlor. Även mindre partiklar som proteiner, kolhydrater, metalljoner eller andra kemiska föreningar konjugeras på mikropärlorna. Varje bindande partikel som är fäst vid mikropärlan kan antas binda i ett 1:1-förhållande med det lösta provet som skickas genom kolonnen som behöver renas eller separeras.
Bindning mellan målmolekylen som ska separeras och bindningsmolekylen på kolonnpärlorna kan modelleras med en enkel jämviktsreaktion K eq = [CS]/([C][S]) där Keq är jämviktskonstanten, [C] och [S] är koncentrationerna av målmolekylen respektive den bindande molekylen på kolonnhartset. [CS] är koncentrationen av komplexet av målmolekylen bunden till kolonnhartset.[8] Med detta som grund kan tre olika isotermer användas för att beskriva bindningsdynamiken för en kolonnkromatografi: linjär, Langmuir och Freundlich. Den linjära isotermen uppstår när koncentrationen av lösta ämnen som behövs för att renas är mycket liten i förhållande till den bindande molekylen. Sålunda kan jämvikten definieras som:
- [CS] = Keq[C].
För användning i industriell skala måste de totala bindande molekylerna på kolonnhartspärlorna räknas in eftersom obesatta ställen måste tas med i beräkningen. Langmuir -isotermen och Freundlich-isotermen är användbara för att beskriva denna jämvikt. Langmuir-isotermen ges av:
- [CS] = (KeqStot[C])/(1 + Keq[C]), där S tot är de totala bindande molekylerna på pärlorna.
Freundlich-isotermen ges av:
- [CS] = Keq[C]1/n
Freundlich-isotermen används när kolonnen kan binda till många olika prover i lösningen som behöver renas. Eftersom de många olika proverna har olika bindningskonstanter till pärlorna, finns det många olika Kekv. Därför är Langmuir-isotermen inte en bra modell för bindning i detta fall.[8]
Se även
- Flashkromatografi, en reningsmetod som används inom organisk kemi
- HPLC (högupplösande vätskekromatografi)
- Gaskromatografi
- Gelfiltrering
- Jonbyteskromatografi
- Adsorptionskromatografi
- Fördelningskromatografi
- Affinitetskromatografi
- Snabb proteivätskekromatografi (FPLC) – separation av proteiner med hjälp av kolonnkromatografi
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, 10 juli 2024.
Noter
- ^ Shusterman, AJ; McDougal, PG; Glasfeld, A (1997). ”Dry-Column Flash Chromatography”. J Chem Educ 74 (10): sid. 1222. doi:10.1021/ed074p1222. ISSN 0021-9584.
- ^ ”How to set-up a flash chromatography silica column and actually succeed at separation”. reachdevices.com. REACH Devices, LLC. http://www.reachdevices.com/SetUpColumn.html. Läst 3 januari 2019.
- ^ Furniss, Brian S.; Hannaford, Antony, J.; Smith, Peter W. G.; Tatchell, Austin S. (1989). Vogel's Textbook of Practical Organic Chemistry. Longman Scientific & Technical. sid. 203. ISBN 978-0582462366
- ^ Still, WC; Kahn, M; Mitra, A (1978). ”Rapid chromatographic technique for preparative separations with moderate resolution”. J Org Chem (ACS) 43 (14): sid. 2923–2925. doi:10.1021/jo00408a041.
- ^ Harwood, Laurence M.; Moody, Christopher J. (13 juni 1989). Experimental organic chemistry: Principles and Practice (Illustrated). London: Blackwell. sid. 180–185. ISBN 978-0-632-02017-1. OCLC 1079261960. https://archive.org/details/experimentalorga00harw
- ^ ”Material Harvest Silica Gel for Normal Phase Column Chromatography”. Material Harvest. 2008. http://www.materialharvest.com/welcome/silica_products/silica_gels_chromatography.html. Läst 3 januari 2019.
- ^ Fair, JD; Kormos, CM (2008). ”Flash column chromatograms estimated from thin-layer chromatography data”. J Chromatogr A 1211 (1–2): sid. 49–54. doi:10.1016/j.chroma.2008.09.085. ISSN 0021-9673. PMID 18849041.
- ^ [a b] Harrison, Roger G; Todd, Paul W.; Rudge, Scott R.; Petrides, Demetri P. (2003). Bioseparations science and engineering (2nd). New York, NY: Oxford University Press. ISBN 9780190213732. OCLC 899240244
Externa länkar
 Wikimedia Commons har media som rör Kolonnkromatografi.
Wikimedia Commons har media som rör Kolonnkromatografi.- Flash Column Chromatography Guide (pdf)
- Radial Flow Chromatography
|








