Tétrafluoroborate de triéthyloxonium
| Tétrafluoroborate de triéthyloxonium | |||
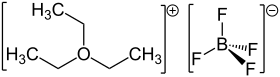 | |||
| Structure du tétrafluoroborate de triéthyloxonium | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | tétrafluoroborate de triéthyloxidanium | ||
| No CAS | 368-39-8 | ||
| No ECHA | 100.006.096 | ||
| No CE | 206-705-1 | ||
| PubChem | 2723982 | ||
| SMILES | [B-](F)(F)(F)F.CC[O+](CC)CC PubChem, vue 3D | ||
| InChI | Std. InChI : vue 3D InChI=1S/C6H15O.BF4/c1-4-7(5-2)6-3;2-1(3,4)5/h4-6H2,1-3H3;/q+1;-1 Std. InChIKey : IYDQMLLDOVRSJJ-UHFFFAOYSA-N | ||
| Propriétés chimiques | |||
| Formule | C6H15BF4O | ||
| Masse molaire[1] | 189,987 ± 0,013 g/mol C 37,93 %, H 7,96 %, B 5,69 %, F 40 %, O 8,42 %, | ||
| Précautions | |||
| SGH[2] | |||
 Danger H314 : Provoque de graves brûlures de la peau et des lésions oculaires P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P310 : Appeler immédiatement un CENTRE ANTIPOISON ou un médecin. P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer. | |||
| Transport[2] | |||
Numéro ONU : 3261 : SOLIDE ORGANIQUE CORROSIF, ACIDE, N.S.A. Classe : 8 Étiquette :  8 : Matières corrosives Emballage : Groupe d'emballage II : matières moyennement dangereuses ; | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
modifier  | |||
Le tétrafluoroborate de triéthyloxonium est un composé chimique de formule (CH3CH2)3OBF4, souvent abrégée Et3OBF4. Il s'agit d'un solide blanc soluble dans les solvants polaires inertes tels que le dichlorométhane CH2Cl2, le dioxyde de soufre SO2 et le nitrométhane CH3NO2. Il est distribué commercialement dans l'éther diéthylique CH3CH2OCH2CH3. D'autres sels de triéthyloxonium que le tétrafluoroborate sont également disponibles[3]. Le tétrafluoroborate de triéthyloxonium est l'un des sels de Meerwein, du nom du chimiste allemand Hans Meerwein qui les a découverts[4]. C'est un agent alkylant très énergique apparenté au tétrafluoroborate de triméthyloxonium (CH3)3OBF4.
On obtient le tétrafluoroborate de triéthyloxonium à partir de trifluorure de bore BF3, d'éther diéthylique (CH3CH2)2O et d'épichlorhydrine CH2(O)CHCH2Cl[5] :
- 4 Et2O·BF3 + 2 Et2O + 3 CH2(O)CHCH2Cl → 3 Et3O+BF4− + B[(OCH(CH2Cl)CH2OEt]3.
Le sel de triméthyloxonium est obtenu à partir de l'éther diméthylique (CH3)2O par une voie analogue[6]. Ces sels ne sont pas stables à température ambiante, et se dégradent par hydrolyse :
- [(CH3CH2)3O]+BF4− + H2O → (CH3CH2)2O + CH3CH2OH + HBF4.
La propension des sels de trialkyloxonium aux échanges de groupes alkyle peut être mise à profit par exemple pour favoriser la solubilisation du tétrafluoroborate de triméthyloxonium en alkyloxonium d'ordre supérieur, par conséquent davantage soluble dans les solvants compatibles, ce qui accélère les réactions d'alkylation[7].
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a et b Fiche Sigma-Aldrich du composé Triethyloxonium tetrafluoroborate ≥ 97.0% (T), consultée le 20 mai 2018.
- ↑ (en) Hartwig Perst et Dave G. Seapy, « Triethyloxonium Tetrafluoroborate », Encyclopedia of Reagents for Organic Synthesis, vol. 1, (DOI 10.1002/047084289X.rt223.pub2, lire en ligne).
- ↑ (de) Hans Meerwein, Gerhard Hinz, Paul Hofmann, Erwin Kroning et Emanuel Pfeil, « Über Tertiäre Oxoniumsalze, I », Journal für praktische Chemie, vol. 147, nos 10-12, (DOI 10.1002/prac.19371471001, lire en ligne).
- ↑ (en) H. Meerwein, B. C. Anderson, O. H. Vogl et B. C. McKusick, « Triethyloxonium Fluoroborate », Organic Syntheses, vol. 46, (DOI 10.15227/orgsyn.046.0113, lire en ligne).
- ↑ (en) T. J. Curphey, A. Eschenmoser, R. Keese et A. Daniel, « Trimethyloxonium Tetrafluoroborate », Organic Syntheses, vol. 51, , p. 142 (DOI 10.15227/orgsyn.051.0142, lire en ligne)
- ↑ (en) Ashish P. Vartak et Peter A. Crooks, « A Scalable, Enantioselective Synthesis of the α2-Adrenergic Agonist, Lofexidine », Organic Process Research & Development, vol. 13, no 3, , p. 415-419 (DOI 10.1021/op8002689, lire en ligne).
 Portail de la chimie
Portail de la chimie










