(Benzène)chrome tricarbonyle
| (Benzène)chrome tricarbonyle | |
 | |
| Structure du (benzène)chrome tricarbonyle | |
| Identification | |
|---|---|
| No CAS | 12082-08-5 |
| No ECHA | 100.031.939 |
| No CE | 235-146-6 |
| SMILES | [C-]#[O+].[C-]#[O+].[C-]#[O+].C1=CC=CC=C1.[Cr] PubChem, vue 3D |
| InChI | Std. InChI : vue 3D InChI=1S/C6H6.3CO.Cr/c1-2-4-6-5-3-1;3*1-2;/h1-6H;;;; Std. InChIKey : WVSBQYMJNMJHIM-UHFFFAOYSA-N |
| Propriétés chimiques | |
| Formule | C9H6CrO3 |
| Masse molaire[1] | 214,138 2 ± 0,009 1 g/mol C 50,48 %, H 2,82 %, Cr 24,28 %, O 22,41 %, |
| Propriétés physiques | |
| T° fusion | 163 à 166 °C[2] |
| Précautions | |
| SGH[2] | |
 Attention H302+H312+H332 : Nocif en cas d'ingestion, par contact cutané ou si inhalé P261 : Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. P264 : Se laver … soigneusement après manipulation. P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P301+P312 : En cas d'ingestion : appeler un CENTRE ANTIPOISON ou un médecin en cas de malaise. P302+P352+P312 : En cas de contact avec la peau : laver abondamment à l’eau. Appeler un CENTRE ANTIPOISON/un médecin en cas de malaise. P304+P340+P312 : En cas d'inhalation : transporter la personne à l’extérieur et la maintenir dans une position où elle peut confortablement respirer. Appeler un CENTRE ANTIPOISON/un médecin en cas de malaise. | |
| Unités du SI et CNTP, sauf indication contraire. | |
modifier  | |
Le (benzène)chrome tricarbonyle est un complexe organochromique (en) de formule chimique (η6-C6H6)Cr(CO)3. Il s'agit d'un solide cristallisé jaune, soluble dans les solvants organiques apolaires. La molécule adopte une géométrie en tabouret de piano[3]. Il a été préparé pour la première fois en 1957 par Fischer et Öfele par carbonylation de bis(benzène)chrome (η6-C6H6)2Cr[4], ce qui donne essentiellement de l'hexacarbonyle de chrome Cr(CO)6 avec des traces de (η6-C6H6)Cr(CO)3 ; la synthèse a été optimisée par réaction subséquente de l'hexacarbonyle de chrome formé avec le bis(benzène)chrome. La réaction industrielle fait intervenir l'hexacarbonyle de chrome avec le benzène C6H6 :
- Cr(CO)6 + C6H6 ⟶ (η6-C6H6)Cr(CO)3 + 3 CO.
Applications
Les complexes de type (arène)Cr(CO)3 ont été étudiés en détail comme réactifs en synthèse organique[5]. Le cycle aromatique du (benzène)chrome tricarbonyle est significativement plus électrophile que le benzène lui-même, ce qui lui permet de réaliser des additions nucléophiles[6].
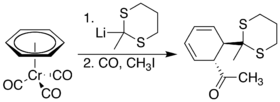
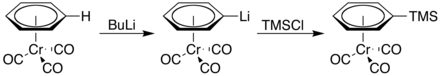
Le n-butyllithium permet la lithiation du ligand benzénique en raison de l'acidité accrue de ce dernier. L'organolithien qui en résulte peut à son tour intervenir comme nucléophile dans diverses réactions, comme avec le chlorure de triméthylsilyle (CH3)3SiCl :
Le (benzène)chrome tricarbonyle est un catalyseur utile pour l'hydrogénation des 1,3-diènes ; il n'hydrogène pas les doubles liaisons isolées.
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a et b Fiche Sigma-Aldrich du composé Benzene-chromium(0) tricarbonyl, consultée le 26 mai 2022.
- ↑ (en) Thomas M. Gilbert, Cary B. Bauer et Robin D. Rogers, « Structures of (η6-benzene dimethylacetal)- and (η6-benzene diethylacetal)chromium tricarbonyl: structural evidence for the near-electroneutrality of the dialkylacetal substituent », Journal of Chemical Crystallography, vol. 26, no 5, , p. 355-360 (DOI 10.1007/BF01677100, S2CID 91957129, lire en ligne)
- ↑ (de) Ernst Otto Fischer et Karl Öfele, « Über Aromatenkomplexe von Metallen, XIII Benzol-Chrom-Tricarbonyl », Chemische Berichte, vol. 90, no 11, , p. 2532-2535 (DOI 10.1002/cber.19570901117, lire en ligne)
- ↑ (en) E. Peter Kündig, « Synthesis of Transition Metal η6-Arene Complexes », Transition Metal Arene π-Complexes in Organic Synthesis and Catalysis, , p. 3-20 (DOI 10.1007/b94489, lire en ligne)
- ↑ (en) James W. Herndon et Stéphane Laurent, « (η6-Benzene)tricarbonylchromium », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rb025.pub2, lire en ligne)
v · m | |||
|---|---|---|---|
| Cr(0) |
| ||
| Cr(II) |
| ||
| Cr(II,III) |
| ||
| Cr(III) |
| ||
| Cr(IV) |
| ||
| Cr(V) |
| ||
| Cr(VI) |
| ||
 Portail de la chimie
Portail de la chimie








