Kohlenstoff-Wasserstoff-Bindung
Die Kohlenstoff-Wasserstoff-Bindung ist eine chemische Bindung zwischen Kohlenstoff und Wasserstoff, die als Grundlage der organischen Chemie gilt und in zahlreichen Molekülen vorkommt.[1] Es handelt sich hierbei um eine kovalente Einfachbindung. Kohlenstoff teilt in dieser Bindung seine äußeren Valenzelektronen mit bis zu vier Wasserstoffatomen. Weil so alle Valenzschalen voll sind, ist die resultierende Verbindung stabil.[2]
Die Kohlenstoff-Wasserstoff-Bindung hat im Triradikal Methin eine Bindungslänge von 1.09 Å (109 Pikometer) und eine Bindungsenergie von etwa 413 kJ/mol. Auf der Pauling-Skala hat Kohlenstoff eine Elektronegativität von 2,55, während Wasserstoff eine von 2,2 besitzt, der Unterschied liegt bei 0,35.[3] Aufgrund von diesem geringen Unterschied gilt die Bindung allgemein als unpolar. Stabile Verbindungen, die ausschließlich aus Kohlenstoff-Wasserstoff-Bindungen und Kohlenstoff-Kohlenstoff-Bindungen bestehen gehören zu einer der folgenden Gruppen: Alkane, Alkene, Alkine und Aromaten.
Ein Molekül, welches ausschließlich aus einer einzigen Kohlenstoff-Wasserstoff-Bindung besteht, ist ein Radikal und nennt sich Methin. Es handelt sich dabei um ein hochreaktives, farbloses Gas, welches nur im interstellaren Raum stabil anzutreffen ist.[4]
Die Länge einer Kohlenstoff-Wasserstoff-Bindung hängt von der Hybridisierung des Kohlenstoffatoms ab. Ein höherer s-Anteil des Kohlenstoffs führt dabei zu kürzeren Bindungen.[5] So ist die Bindung zwischen einem Wasserstoffatom und einem sp2-hybridisierten Kohlenstoffatom im Ethen ungefähr 1,1 % kürzer als zwischen einem Wasserstoffatom und einem sp3-hybridisiertem Kohlenstoffatom im Ethan. Eine Bindung zwischen Wasserstoff und einem sp-hybridisierten Kohlenstoffatom im Ethin ist hingegen circa 3 % kürzer als die im Ethan.[6]
| Name | Methan | Ethan | Ethen | Ethin |
|---|---|---|---|---|
| Formel | CH4 | C2H6 | C2H4 | C2H2 |
| Gruppe | Alkane | Alkane | Alkene | Alkine |
| Struktur |  | 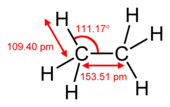 |  |  |
| Hybridisierung des Kohlenstoffatoms | sp3 | sp3 | sp2 | sp |
| Bindungslänge | 1,087 Å | 1,094 Å | 1,082 Å | 1,060 Å |
Die Kohlenstoff-Wasserstoff-Bindung ist sehr stark und damit auch ziemlich reaktionsträge. Nicht aktivierte Kohlenstoff-Wasserstoff-Bindungen finden sich in Alkanen und nehmen normalerweise nur an einer radikalischen Substitution teil.[7]
Obwohl die Kohlenstoff-Wasserstoff-Bindung eine der stärksten ist, schwankt ihre Stärke bei stabilen organischen Verbindungen um über 30 %, auch ohne Heteroatome.[8][9]
Einzelnachweise
- ↑ Jerry March: Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. Wiley, 1985, ISBN 978-0-471-85472-2.
- ↑ Life Sciences Cyberbridge. 18. September 2015, abgerufen am 3. August 2024 (englisch).
- ↑ Die Elemente des Periodensystems geordnet nach der Elektronegativität. In: Lenntech. Abgerufen am 3. August 2024.
- ↑ William M. Irvine: Encyclopedia of Astrobiology. Springer, Berlin, Heidelberg 2020, ISBN 978-3-642-27833-4, Methylidyne (CH), S. 1–2, doi:10.1007/978-3-642-27833-4_1807-5.
- ↑ Hans Peter Latscha, Uli Kazmaier, Helmut Klein: Organische Chemie: Chemie-Basiswissen II. Springer, Berlin, Heidelberg 2023, ISBN 978-3-662-67010-1, Chemische Bindung in organischen Verbindungen, S. 14–15, doi:10.1007/978-3-662-67010-1_1.
- ↑ a b W. M. Haynes: CRC Handbook of Chemistry and Physics. 95. Auflage. CRC Press, 2014, S. 9–31–9–40, doi:10.1201/b17118.
- ↑ J Martin Bollinger, Joan B Broderick: Frontiers in enzymatic C–H-bond activation. In: Current Opinion in Chemical Biology. Band 13, Nr. 1, Februar 2009, S. 51–57, doi:10.1016/j.cbpa.2009.03.018 (englisch).
- ↑ Standard Bond Energies. 29. August 2016, abgerufen am 3. August 2024 (englisch).
- ↑ CRC Handbook of Chemistry and Physics, 96. Edition








