Valenční izomerie
Valenční izomery jsou molekuly, které jsou navzájem strukturními izomery, jež se mohou přeměňovat jeden v druhý pericyklickými reakcemi.[1][2]
Benzen
Benzen (C6H6) má několik možných valenčních izomerů; některé byly navrženy pro samotný benzen dříve, než byla objasněna jeho struktura, další byly připraveny v laboratořích. U některých se prokázala izomerizace na benzen, zatímco další vstupovaly do jiných reakcí, nebo se izomerizovaly jinými než pericyklickými reakcemi.
- Některé valenční izomery benzenu
-
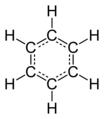 Benzen
Benzen -
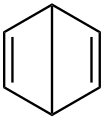 Dewarův benzen
Dewarův benzen -
 Prisman
Prisman -
 Benzvalen
Benzvalen -
 Bicyklopropenyl
Bicyklopropenyl
Cyklooktatetraen
Valenční izomery se vyskytují i u molekul odpovídajících jiným vzorcům, například (CH)8; tyto látky mají vzhledem k většímu počtu atomů v molekulách také více valenčních izomerů, pro (CH)8 jich je známo 21:
- Valenční izomery cyklooktatetraenu
-
 Cyklooktatetraen
Cyklooktatetraen -
 Barelen
Barelen -
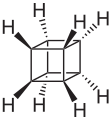 Kuban
Kuban -
 Kunean
Kunean -
 Semibulvalen
Semibulvalen -
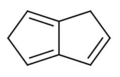 1,5-dihydropentalen
1,5-dihydropentalen -
![2a,2b,4a,4b-Tetrahydrocyklopropa[cd]pentalen](//upload.wikimedia.org/wikipedia/commons/thumb/5/5f/2a%2C2b%2C4a%2C4b-tetrahydrocyclopropa_cd_pentalene.png/120px-2a%2C2b%2C4a%2C4b-tetrahydrocyclopropa_cd_pentalene.png) 2a,2b,4a,4b-Tetrahydrocyklopropa[cd]pentalen
2a,2b,4a,4b-Tetrahydrocyklopropa[cd]pentalen -
![Bicyklo[4.2.0]okta-2,4,7-trien, tautomer cyklooktatetraenu přeměňující se šestielektronovou tepelnou nebo čtyřelektronovou fotochemickou reakcí[3][4][5]](//upload.wikimedia.org/wikipedia/commons/thumb/f/fe/Bicyclo420octa247triene.svg/97px-Bicyclo420octa247triene.svg.png) Bicyklo[4.2.0]okta-2,4,7-trien, tautomer cyklooktatetraenu přeměňující se šestielektronovou tepelnou nebo čtyřelektronovou fotochemickou reakcí[3][4][5]
Bicyklo[4.2.0]okta-2,4,7-trien, tautomer cyklooktatetraenu přeměňující se šestielektronovou tepelnou nebo čtyřelektronovou fotochemickou reakcí[3][4][5] -
![Tricyklo[3,3,0,02,6]okta-3,8-dien. Za pokojové teploty se izomerizuje na semibulvalen, stálý je okolo −60 °C.[6][7][8][9]](//upload.wikimedia.org/wikipedia/commons/thumb/8/84/Tricyclo33006octa38diene.svg/120px-Tricyclo33006octa38diene.svg.png) Tricyklo[3,3,0,02,6]okta-3,8-dien. Za pokojové teploty se izomerizuje na semibulvalen, stálý je okolo −60 °C.[6][7][8][9]
Tricyklo[3,3,0,02,6]okta-3,8-dien. Za pokojové teploty se izomerizuje na semibulvalen, stálý je okolo −60 °C.[6][7][8][9] -
![Tricyklo[4,2,0,02,5]okta-3,7-dien. Tento dimer cyklobutadienu vytváří cis a trans izomer; oba tyto izomery se přeměňují na cyklooktatetraen, poločas této přeměny činí při 140 °C 20 minut.[10]](//upload.wikimedia.org/wikipedia/commons/thumb/b/b3/Cyclobutadiene_dimer_cis_trans.svg/120px-Cyclobutadiene_dimer_cis_trans.svg.png) Tricyklo[4,2,0,02,5]okta-3,7-dien. Tento dimer cyklobutadienu vytváří cis a trans izomer; oba tyto izomery se přeměňují na cyklooktatetraen, poločas této přeměny činí při 140 °C 20 minut.[10]
Tricyklo[4,2,0,02,5]okta-3,7-dien. Tento dimer cyklobutadienu vytváří cis a trans izomer; oba tyto izomery se přeměňují na cyklooktatetraen, poločas této přeměny činí při 140 °C 20 minut.[10] -
![Tetracyklo[3,3,0,02,4,03,6]okt-7-en není popsán jako samotná sloučenina, znám je pouze v podobě 4-karbomethoxylovaného derivátu.[11]](//upload.wikimedia.org/wikipedia/commons/thumb/4/43/Tetracyclooctaene.svg/120px-Tetracyclooctaene.svg.png) Tetracyklo[3,3,0,02,4,03,6]okt-7-en není popsán jako samotná sloučenina, znám je pouze v podobě 4-karbomethoxylovaného derivátu.[11]
Tetracyklo[3,3,0,02,4,03,6]okt-7-en není popsán jako samotná sloučenina, znám je pouze v podobě 4-karbomethoxylovaného derivátu.[11] -
![Tetracyklo[4,2,0,02,4,03,5]okt-7-en lze připravit z benzvalenu; izomerizuje se na cyklooktatetraen.[12]](//upload.wikimedia.org/wikipedia/commons/thumb/f/fe/Tetracyclooct-7-ene.svg/120px-Tetracyclooct-7-ene.svg.png) Tetracyklo[4,2,0,02,4,03,5]okt-7-en lze připravit z benzvalenu; izomerizuje se na cyklooktatetraen.[12]
Tetracyklo[4,2,0,02,4,03,5]okt-7-en lze připravit z benzvalenu; izomerizuje se na cyklooktatetraen.[12] -
![Pentacyklo[5.1.0.02,4.03,5.06,8]oktan (oktabisvalen) je třetím nasyceným valenčním izomerem. (Z)-3,7-fenylsulfonylový derivát je za teplot do 200 °C stálý.[13]](//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Octabisvalene.svg/120px-Octabisvalene.svg.png) Pentacyklo[5.1.0.02,4.03,5.06,8]oktan (oktabisvalen) je třetím nasyceným valenčním izomerem. (Z)-3,7-fenylsulfonylový derivát je za teplot do 200 °C stálý.[13]
Pentacyklo[5.1.0.02,4.03,5.06,8]oktan (oktabisvalen) je třetím nasyceným valenčním izomerem. (Z)-3,7-fenylsulfonylový derivát je za teplot do 200 °C stálý.[13] -
![Tricyklo[5.1.0.02,8]okta-3,5-dien (oktavalen) byl vytvořen z homobenzvalenu a při 50 °C se mění na cyklooktatetraen.[14][15]](//upload.wikimedia.org/wikipedia/commons/thumb/7/76/Octavalene.svg/108px-Octavalene.svg.png) Tricyklo[5.1.0.02,8]okta-3,5-dien (oktavalen) byl vytvořen z homobenzvalenu a při 50 °C se mění na cyklooktatetraen.[14][15]
Tricyklo[5.1.0.02,8]okta-3,5-dien (oktavalen) byl vytvořen z homobenzvalenu a při 50 °C se mění na cyklooktatetraen.[14][15]
Naftalen a azulen
Dvojicí valenčních izomerů s velmi odlišným vzhledem jsou bezbarvý naftalen a výrazně modrý azulen.
- Valenční izomery naftalenu
-
 Naftalen
Naftalen -
 Azulen
Azulen
Benzenoxid a oxepin

Reference
V tomto článku byl použit překlad textu z článku Valence isomer na anglické Wikipedii.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.v06590. (anglicky) DOI: 10.1351/goldbook.
- ↑ Rearrangements and interconversions of compounds of the formula (CH)n Lawrence T. Scott, Maitland. Jones Chemical Reviews, 1972, 72 (2), 181–202 DOI:10.1021/cr60276a004Je zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“. - ↑ R. Huisgen; F. Mietzsch. The Valence Tautomerism of Cyclooctatetraene. Angewandte Chemie International Edition in English. 1964, s. 83. DOI 10.1002/anie.196400831.
- ↑ Bicyclo[4,2,0]octa-2,4,7-triene Emanuel Vogel, H. Kiefer, W. R. Roth Volume 3, Issue 6, pages 442–443, June 1964 DOI:10.1002/anie.196404422Je zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“. - ↑ Rolf Huisgen; Will E. Konz; George E. Gream. Evidence for different valence tautomers of bromocyclooctatetraene. Journal of the American Chemical Society. 1970, s. 410. DOI 10.1021/ja00716a048.
- ↑ Jerrold Meinwald; Haruki Tsuruta. Tricyclo[3.3.0.02,6]octa-3,7-diene. Journal of the American Chemical Society. 1969, s. 5877. DOI 10.1002/anie.196400831.
- ↑ Jerrold Meinwald; Douglass Schmidt. Semibullvalene from tricyclo[3.3.0.02,6]octane. Journal of the American Chemical Society. 1969. DOI 10.1021/ja01049a033.
- ↑ Howard Elliot Zimmerman; Jeffrey D. Robbins; Joachim Schantl. C8H8 interconversions. An unusual rearrangement providing a new route to semibullvalene. Journal of the American Chemical Society. 1969, s. 5878. DOI 10.1021/ja01049a035.
- ↑ Jerrold Meinwald; Haruki Tsuruta. (CH)8 hydrocarbons. Photochemistry of tricyclo[3.3.0.02,6]octa-3,7-diene. Journal of the American Chemical Society. 1970, s. 2579. DOI 10.1021/ja00711a078.
- ↑ Untersuchungen in der Cyclobutanreihe, XII. Zwei stereoisomere Dimere des Cyclobutadiens Margarete Avram, Ilie G. Dinulescu, Elise Marica, Georg Mateescu, Elvira Sliam, Costin D. Nenitzescu, Chemische Berichte Volume 97, Issue 2, pages 382–389, February 1964 DOI:10.1002/cber.19640970210Je zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“. - ↑ Methyl tetracyclo[3.3.0.02,4O3,6]cot-7-ene-4-carboxylate Gerhard W. Klumpp, W. G. J. Rietman, J. J. Vrielink Journal of the American Chemical Society, 1970, 92 (17), 5266–5267 DOI:10.1021/ja00720a071Je zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“. - ↑ Synthesis and reactions of tetracyclo[4.2.0.02,4.03,5]octanes Leverett R. Smith, George E. Gream, Jerrold Meinwald The Journal of Organic Chemistry, 1977, 42 (6), 927–936 DOI:10.1021/jo00426a001Je zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“. - ↑ (Z)-3,7 Bis(phenylsulfonyl)pentacyclo[5.1.0.02,4.03,5.06,8]octane, an Octabisvalene Derivative (1985) Angewandte Chemie International Edition in English Volume 24, Issue 5, pages 411–412 DOI:10.1002/anie.198504111Je zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“. - ↑ The synthesis of octavalene (tricyclo[5.1.0.02,8]octa-3,5-diene) and several substituted octavalenes Tetrahedron Volume 42, Issue 6, 1986, Pages 1585-1596 Manfred Christl, Reinhard Lang and Clemens Herzog DOI:10.1016/S0040-4020(01)87575-XJe zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“. - ↑ Electronic structure of octavalene. Photoelectron spectroscopic investigations Rolf Gleiter, Peter Bischof, Manfred Christl The Journal of Organic Chemistry, 1986, 51 (15), 2895–2898 DOI:10.1021/jo00365a007Je zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“. - ↑ E. Vogel; H. Günther. Benzene Oxide-Oxepin Valence Tautomerism. Angewandte Chemie International Edition in English. 1967, s. 385–401. DOI 10.1002/anie.196703851.
Externí odkazy
 Obrázky, zvuky či videa k tématu valenční izomerie na Wikimedia Commons
Obrázky, zvuky či videa k tématu valenční izomerie na Wikimedia Commons











![2a,2b,4a,4b-Tetrahydrocyklopropa[cd]pentalen](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5f/2a%2C2b%2C4a%2C4b-tetrahydrocyclopropa_cd_pentalene.png/120px-2a%2C2b%2C4a%2C4b-tetrahydrocyclopropa_cd_pentalene.png)
![Bicyklo[4.2.0]okta-2,4,7-trien, tautomer cyklooktatetraenu přeměňující se šestielektronovou tepelnou nebo čtyřelektronovou fotochemickou reakcí[3][4][5]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/fe/Bicyclo420octa247triene.svg/97px-Bicyclo420octa247triene.svg.png)
![Tricyklo[3,3,0,02,6]okta-3,8-dien. Za pokojové teploty se izomerizuje na semibulvalen, stálý je okolo −60 °C.[6][7][8][9]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/84/Tricyclo33006octa38diene.svg/120px-Tricyclo33006octa38diene.svg.png)
![Tricyklo[4,2,0,02,5]okta-3,7-dien. Tento dimer cyklobutadienu vytváří cis a trans izomer; oba tyto izomery se přeměňují na cyklooktatetraen, poločas této přeměny činí při 140 °C 20 minut.[10]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b3/Cyclobutadiene_dimer_cis_trans.svg/120px-Cyclobutadiene_dimer_cis_trans.svg.png)
![Tetracyklo[3,3,0,02,4,03,6]okt-7-en není popsán jako samotná sloučenina, znám je pouze v podobě 4-karbomethoxylovaného derivátu.[11]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/43/Tetracyclooctaene.svg/120px-Tetracyclooctaene.svg.png)
![Tetracyklo[4,2,0,02,4,03,5]okt-7-en lze připravit z benzvalenu; izomerizuje se na cyklooktatetraen.[12]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/fe/Tetracyclooct-7-ene.svg/120px-Tetracyclooct-7-ene.svg.png)
![Pentacyklo[5.1.0.02,4.03,5.06,8]oktan (oktabisvalen) je třetím nasyceným valenčním izomerem. (Z)-3,7-fenylsulfonylový derivát je za teplot do 200 °C stálý.[13]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Octabisvalene.svg/120px-Octabisvalene.svg.png)
![Tricyklo[5.1.0.02,8]okta-3,5-dien (oktavalen) byl vytvořen z homobenzvalenu a při 50 °C se mění na cyklooktatetraen.[14][15]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/76/Octavalene.svg/108px-Octavalene.svg.png)











